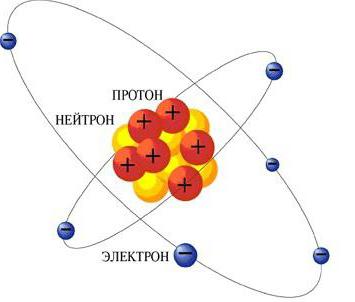
Željezo: struktura atoma, shema i primjeri. Elektronička struktura željezovog atoma
Razmotrimo elektronsku strukturu željezovog atoma, kao i njegovo mjesto u periodičnom stolu. Otkrivamo osnovna fizikalna i kemijska svojstva ovog elementa, polja upotrebe.

Položaj u PS
Željezo je d-element grupe 8 (pomoćnipodgrupa). Ima 26 rednih brojeva, relativna atomska masa je 56, atom sadrži 26 protona, 26 elektrona i 30 neutrona. Ovaj metal ima prosječnu kemijsku aktivnost, pokazuje smanjenje svojstava. Karakteristični stupnjevi oksidacije: +2, +3.
Značajke strukture atoma
Koja je elektronička shema strukture željezovog atoma? Ako uzmemo u obzir distribuciju elektrona iznad razine energije, dobivamo sljedeću varijantu:
2e; 8e; 14 e; 2e. Takva struktura ljuske elektrona željeznog atoma ukazuje na njegovo mjesto u podskupini, potvrđuje pripadnost g-obitelji elemenata.

Biti u prirodi
Željezni je jedan od najvažnijihzajednički u prirodi kemijskih elemenata. U zemljinoj koru, njegov postotak iznosi oko 5,1%. U većem broju u utrobi našeg planeta postoje samo tri elementa: silicij, aluminij, kisik.
Željezne rude se nalaze u različitim dijelovima Zemlje. Alkemičari su pronašli spojeve ovog metala u tlu. U proizvodnji željeza, odabrana je ruda u kojoj njegov sadržaj prelazi 30 posto.
Magnetsko željezo sadrži oko sedamdesetdva posto metala. Glavni naslovi magnetita nalaze se u magnetnoj anomaliji Kursk, kao iu južnim Uralsima. U krvi postotak željeza doseže 65 posto. Hematit je otkriven u okrugu Krivoy Rog.

Važnost za biljke i životinje
Koja uloga igra željezo u živim organizmima? Struktura atoma objašnjava njezina redukcijska svojstva. Ovaj je kemijski element dio hemoglobina, što mu daje karakterističnu crvenu boju. Oko tri grama čistog željeza, od kojih je većina uključeno u hemoglobin, nalazi se u tijelu odrasle osobe. Glavna svrha je prenošenje tkiva iz pluća aktivnog kisika, kao i izlaz formiranog ugljičnog dioksida.
Ovaj metal i biljke su potrebne. Budući da je dio citoplazme, on aktivno sudjeluje u procesima fotosinteze. Ako biljka nema željezo, njezini lišće su bijele boje. S minimalnim gornjim preljevom željeznim solima, listovi biljaka postaju zeleni.

Fizička svojstva
Razmatrali smo strukturu željezovog atoma. Krug potvrđuje prisutnost metalnog lustera (postoje valenti elektroni) u ovom elementu. Srebrno-bijeli metal ima prilično visoku točku taljenja (1539 stupnja Celzijusa). Zbog dobre plastičnosti ovaj metal se lako podvrgava valjanju, prešanju i kovanja.
Sposobnost magnetiziranja i demagnetizacije, karakteristična za željezo, učinila ga je izvrsnim materijalom za proizvodnju jezgri moćnih elektromagneta u različitim aparatima i električnim strojevima.
Koliko je aktivan željezo? Struktura atoma pokazuje prisutnost na vanjskoj razini dva elektrona, koja će se dati tijekom kemijske reakcije. Da bi se povećala njegova tvrdoća i čvrstoća, provodi se dodatno valjanje i stvrdnjavanje metala. Takvi procesi ne prate promjene u strukturi atoma.

Vrste željeza
Elektronička struktura željezovog atoma, čija je shemasmatra se gore, objašnjava njezine kemijske karakteristike. U tehnički čistom metalu, koji je čelik s niskim udjelom ugljika, glavna komponenta je željezo. Kao nečistoće, otkriveno je oko 0,04% ugljika, također su prisutni fosfor, dušik i sumpor.
Kemijski čisto željezo prema vanparametri su slični platini. Povećana otpornost na korozijske procese otporna je na kiseline. U najmanjem uvođenju nečistoća u čisti metal, njene jedinstvene karakteristike nestaju.
Opcije za dobivanje
Struktura atoma aluminija i željeza pokazujeo povezanosti amfoternog aluminija s glavnom podskupinom, mogućnost korištenja u postupku odvajanja željeza od njegovih oksida. Aluminotermija, izvedena na povišenoj temperaturi, omogućuje odvajanje čistog metala od prirodnih rudača. Osim aluminija, vodika, ugljičnog monoksida (2), ugljen je odabran kao jake redukcijska sredstva.
Značajke kemijskih svojstava
Kakva kemijska svojstva imaju željezo? Struktura atoma objašnjava njegovu nadomjesnu aktivnost. Za željezo je karakteristično stvaranje dva reda spojeva koji imaju oksidacijsko stanje od +2, +3.
U vlažnom zraku dolazi do hrđanja(koroziju) metala, što dovodi do stvaranja feridnog hidroksida (3). S kisikom, grijana željezna žica reagira s pojavom crnog praha željeznog oksida (2,3), pod nazivom željezna ljestvica.
Na visokim temperaturama, metal reagira s vodenom parom, čime nastaje miješani oksid. Proces je praćen evolucijom vodika.
Reakcija s ne-metalima događa se samo kada su početne komponente prethodno zagrijane.
Željezo se može otopiti u razrijeđenim sumpornim ili kloridnim kiselinama bez zagrijavanja smjese. Koncentrirane sulfatne i kloridne kiseline pasivirat će ovaj metal.
Koja druga kemijska svojstva ima željezo? Struktura atoma tog elementa ukazuje na njegovu prosječnu aktivnost. To potvrđuje i mjesto željeza na vodik (H2) u nizu naprezanja. Kao posljedica toga, može se istisnuti iz soli svih metala koji se nalaze desno od serije Beketov. Dakle, u reakciji s bakrenim (2) kloridom, koje se provodi zagrijavanjem, izolira se čisti bakar i dobije se otopina željezovog klorida (2).


Najveći dio svih željeza koristi seproizvodnja lijevanog željeza i čelika. U lijevano željezo, postotak ugljika je 3-4 posto, u čeliku - ne više od 1,4 posto. Ovaj ne-metal obavlja funkciju elementa koji povećava čvrstoću zgloba. Osim toga, pozitivno utječe na svojstva korozije legura, povećava otpornost materijala na povišenu temperaturu.
Dodatci vanadija su nužni radi poboljšanja mehaničke čvrstoće čelika. Krom povećava otpornost na agresivne kemikalije.
Feromagnetska svojstva ove kemikalijeelement je postao potražnja u industrijskim postrojenjima koja uključuju elektromagnete. Osim toga, željezo je pronašlo upotrebu u industriji suvenira. Na njemu se izrađuju razni suveniri, na primjer šareni magneti na hladnjaku.
Snaga i duktilnost omogućuju upotrebu metala za stvaranje oklopa, raznih oružja.
Željezni klorid (3) se koristi za pročišćavanje vode iznečistoće. U medicini 26 elementa periodnog koristi u liječenju takvih bolesti kao što anemije. U slučaju nedostatka crvenih krvnih stanica je umor, koža izgleda neprirodno blijedi ten. željezo pripreme pomoći da se eliminiraju tu vrstu problema, vratite tijelo u normalnim aktivnostima. Od posebne važnosti željezo ima za djelovanje štitne žlijezde, jetre. Tako da je ljudsko tijelo nije bilo ozbiljnih problema, pojesti dovoljno dnevno oko 20 mg metala.