Iskustvo Rutherforda
Ernest Rutherford - jedinstven, vrlo talentirani vrlo neobičan znanstvenik. Valja napomenuti da su mu najvažnija otkrića učinjena nakon što je dobio Nobelovu nagradu. Godine 1911., ovaj čovjek je bio uspjeh iskustva Rutherford (tako se zove kasnije), što je omogućilo da pogledate unutar atoma i dobiti neke ideje o tome kako se to radi.
Provedeni su brojni eksperimenti s atomimai ranije. Njihova glavna ideja je bila da se na različite kutove otklona čestica skupiti dovoljno informacija na kojima postoji mogućnost reći nešto konkretno o strukturi atoma. Početkom 20. stoljeća, znanstvenici su bili uvjereni da ona sadrži u sebi elektroni su negativno nabijeni. Ipak, najčešće se koristi u vrijeme kako bi dobili ideju da je atom poput tanke pozitivno nabijenu rešetku koja je ispunjena elektrona s negativnog naboja. Ovaj model se zove „mreže s grožđicama.”
Iskustvo Rutherforda bilo je jedinstveno. Znanstvenik je sagradio top, koji je dao usmjeren i usmjeren tok čestica. Izgledalo je poput olovne kutije u kojoj je bio uski prorez. Unutar njega je stavljen radioaktivni materijal. Alfa čestice koje su emitirane od strane radioaktivne tvari u svim smjerovima, osim jednog, apsorbira se kroz ekran od olova, a samo kroz prorez, izletjela je određena usmjerena zraka čestica. Na putu je, dakle, instaliran još nekoliko ekrana olova s utorima, koji su odsječeni čestice koje odstupaju od željenog smjera. Kao rezultat ovog eksperimenta u Rutherfordu, fokusirana zraka čestica je letjela do cilja, sama meta bila je vrlo tanka folija. U njemu, i pogodio je alfa-zrak.
Nakon što su se alfa čestice sudaraleatomi folije nastavili su svoj put i na kraju se našli na luminescentnom zaslonu koji je bio postavljen iza cilja. Kada čestice hit zaslon, bljeskalica zabilježen tome, na kojima eksperimentator može suditi kako i na koji količina alfa-čestica skrenut s pravog smjera gibanja uslijed sudara s atomima zlatnoj foliji.
Iskustvo Rutherforda bilo je toliko izvorno,da nitko prije njega nije pokušao provjeriti djeluju li određene čestice u velikim kutovima. Stari model mreže nije dopustio ni postojanje tako teških i gustih elemenata atoma, tako da oni mogu odbiti vrlo brzo alfa čestice na dovoljno velikim kutom.
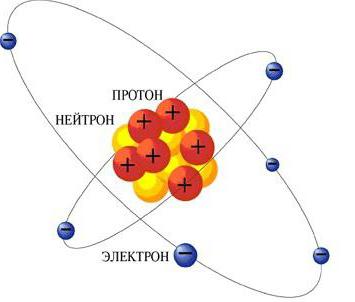
Iskustvo Rutherforda omogućilo je zaključiti da je velikadio mase se koncentrira u vrlo gustoj tvari, koja se nalazi u samom središtu atoma. Ostatak je zapravo bio znatno manji nego što se prije činilo. Atom Rutherford je sadržavao superdenzitni centar, koji se nazivao jezgrom, u kojoj je usput, pozitivna naboja koncentrirana.
Slika atoma, koju je znanstvenik nacrtao, namasada dobro poznat. Rutherfordov model sastoji se u činjenici da u središtu nalazi atomska jezgra s pozitivnim punjenjem, u kojoj se koncentrira cijela masa atoma. Općenito, atom je neutralan. Stoga je broj elektrona unutar, poput napunjenosti jezgre, jednak broju elementa u periodičkom sustavu. Jasno je da se elektroni ne mogu odmarati unutar atoma, jer bi jednostavno mogli pasti na jezgru. Kretali su je na isti način na koji se planeti vrte oko svjetiljke sunca.
Ova vrsta kretanja određena je djelovanjem snagaPrivjesak na strani jezgre. Atomi su stabilni, u neotkrivenom stanju mogu dugo trajati bez emitiranja elektromagnetskih valova. Međutim, planetarni model atoma, iako je opravdan eksperimentalno, ne dopušta nam da objasnimo zašto je stabilna.