Rješenja elektrolita
Rješenja elektrolita su posebnatekućine koje su djelomično ili potpuno u obliku nabijenih čestica (iona). Sam proces razdvajanja molekula u negativne (anione) i pozitivno nabijene (katione) čestice naziva se elektrolitska disocijacija. Disocijacija u otopinama je moguća jedino zbog sposobnosti iona na interakciju s molekulama polarne tekućine koja djeluje kao otapalo.
Koje su elektrolite?

Rješenja elektrolita ovisno o stupnjudisocijacija se može podijeliti na jake, srednje i slabe. Stupanj disocijacije (α) je omjer broja molekula koje su raspadale u napunjene čestice prema ukupnom broju molekula. U jakim elektrolitima, vrijednost α približava 1, za medij α≈0.3, a za slab α <0.1.
Jaki elektroliti obično uključuju soli, niz određenih kiselina - HCl, HBr, HI, HNO3, H2SO4, HClO4, hidrokside barija, stroncija, kalcija i alkalijskih metala. Ostale baze i kiseline su srednji ili slabi elektroliti.
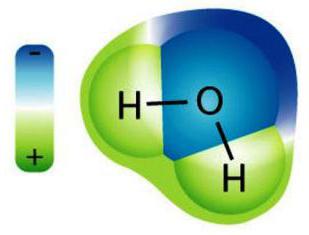
Svojstva otopina elektrolita

- Uništavanje intermolekularnih i kemijskih veza otopljenog elektrolita zahtijeva potrošnju određene količine energije, pa se stoga apsorpcija topline odvija (ΔHbit > 0).
- U ovoj fazi započinje otapalointerakciju s ionima elektrolita, što rezultira formiranjem solvata (u vodenim otopinama - hidrati). Taj se proces naziva solvatacija i egzotermna, tj. E. postoji otpuštanje topline (ΔHhidra <0).
- Posljednja faza je difuzija. Ovo je ujednačena raspodjela hidrata (solvata) u rasutom stanju. Ovaj proces zahtijeva trošak energije i stoga se otopina hladi (ΔHdiferencijal > 0).
Dakle, ukupni toplinski učinak otapanja elektrolita može se napisati u ovom obliku:
? Hsol = ΔHbit + ΔNhidra + ΔNdiferencijal
Posljednji znak cjelokupnog toplinskog učinka otapanja elektrolita ovisi o tome što se konstituiraju energetski učinci. Obično je taj proces endoterman.

Ovisno o otopljenomSve tvari elektrolita rješenja mogu se podijeliti u vrlo razrijeđenim (u kojoj samo sadrži „tragovi” elektrolit), razrijedi (koja sadrži malu količinu otopljene tvari) i koncentrirana (s značajnim elektrolita sadržaja).
Kemijske reakcije u otopinama elektrolita,koji su uzrokovani prolazom električne struje, dovode do oslobađanja određenih tvari na elektrodama. Taj se fenomen naziva elektrolizom i često se koristi u suvremenoj industriji. Posebno, zahvaljujući elektrolizi, dobivaju se aluminij, vodik, klor, natrijev hidroksid, vodikov peroksid i mnoge druge važne tvari.