Reakcija spoja. Primjeri reakcije spoja
Mnogi procesi bez kojih je nemogućezamisliti život (kao što je probava, disanje, fotosinteze, i slično), povezan s raznim kemijskim reakcijama organskih spojeva (i anorganske). Pogledajmo njihove glavne vrste i idemo u više detalja o procesu koji se naziva veza (veza).
Ono što se zove kemijska reakcija
Prije svega, vrijedi dati opću definiciju togafenomen. Pod izrazom razmatranja podrazumijevaju se razne reakcije tvari različitih složenosti, čime se stvaraju različiti proizvodi od inicijalnih proizvoda. Tvari uključene u ovaj proces nazivaju se "reagensima".
Na pismu, kemijska reakcija organskogspojevi (i anorganski) napisali su specijalizirane jednadžbe. Izvana nas podsjećaju na matematičke primjere dodavanja. Međutim, umjesto znaka ("=") upotrebljava se strelica ("→" ili "⇆"). Osim toga, ponekad može biti više supstancija s desne strane jednadžbe nego lijevom. Sve što je prije strelice su tvari prije početka reakcije (lijeva strana formule). Sve što je iza nje (desna strana) - spojevi nastali kao posljedica kemijskog procesa koji se dogodio.
Kao primjer kemijske jednadžbe, može se uzeti u obzir reakcija raspadanja vode u vodik i kisik pod djelovanjem električne struje: 2H2О → 2H2↑ + O2↑. Voda je polazni reagens, a kisik s vodikom su proizvodi.
Kao još jedan, ali složenijiprimjer kemijske reakcije spojeva može se smatrati fenomenom poznatim svakoj domaćici koja je barem jednom pečena slatkiša. Radi se o ukidanju sode za pečenje uz pomoć stolnog octa. Akcija ilustrirana je sljedećom jednadžbom: NaHCO3 +23COOH → 2CH3COONa + CO2↑ + H2O. Jasno je da se natrijeva sol octene kiseline, vode i ugljičnog dioksida formira tijekom interakcije natrijevog hidrogenkarbonata i octa.
Po svojoj prirodi, kemijski procesi zauzimaju međuprostor između fizičkog i nuklearnog.
Za razliku od prve, sudjelovanje u kemijskoj industrijireakcije spoja mogu mijenjati svoj sastav. To jest, iz atoma jedne tvari, može se formirati još nekoliko, kao u prije spomenutoj jednadžbi za razgradnju vode.
Za razliku od nuklearnih reakcija, kemijske reakcije ne utječu na jezgre atoma međusobno povezanih tvari.
Koje su vrste kemijskih procesa
Distribucija reakcija spojeva po vrstama javlja se prema različitim kriterijima:

- Ponovljivost / nepovratnost.
- Prisutnost / odsutnost katalizatora i procesa.
- Na apsorpciju / oslobađanje topline (endotermna / egzotermna reakcija).
- Po broju faza: homogene / heterogene i dvije hibridne sorte.
- Promjenom stupnjeva oksidacije međusobnih tvari.
Vrste kemijskih procesa u anorganskoj kemiji metodom interakcije
Ovaj je kriterij poseban. S njegovom pomoći razlikuju se četiri vrste reakcija: spoj, supstitucija, razgradnja (cijepanje) i razmjena.

Ime svakog od njih odgovara procesu,što ona opisuje. To jest, u spoju supstance se kombiniraju, u supstituciji - one se mijenjaju u druge skupine, od kojih se nekoliko formira u razgradnji jednog reagensa, a u razmjeni sudionici reakcije se međusobno razlikuju po atomima.
Vrste procesa metodom interakcije u organskoj kemiji
Unatoč velikom složenosti, reakcije organskih spojeva pojavljuju se na istom principu kao i anorganski. Međutim, imaju nekoliko različitih imena.
Tako se nazivaju spojeve i reakcije razgradnje"Dodatak", kao i "cijepanje" (eliminacija) i izravno organsko raspadanje (u ovom dijelu kemije postoje dvije vrste cijepanja).
Druge reakcije organskih spojeva susupstitucija (naziv se ne mijenja), redukcija (razmjena) i procesi redukcije oksidacije. Unatoč sličnosti njihovih mehanizama, u organskom su više svestrani.
Kemijska reakcija spoja
Razmatrajući različite vrste procesa koji uključuju tvari u organskoj i anorganskoj kemiji, vrijedi preciznije precizno prebivati.
Ova se reakcija razlikuje od svih ostalih u tome, bez obzira na količinu reagensa na početku, u finalu svi se kombiniraju u jednu.
Kao primjer, možemo se prisjetiti procesa gašenja vapna: CaO + H2O → Ca (OH)2, U tom slučaju, reakcija spojakalcij oksid (vapno vapno) s vodikovim oksidom (vodom). Kao rezultat toga nastaje kalcijev hidroksid (slamnjen vapno) i otpušta se topla para. Usput, to znači da je taj proces doista egzoterman.
Reakcijska jednadžba spoja
Shematski je proces koji se razmatra mogućkako slijedi: A + BV → ABC. U ovoj formuli ABC je novoformirana kompleksna tvar, A je jednostavan reagens, a BV je varijanta složenog spoja.
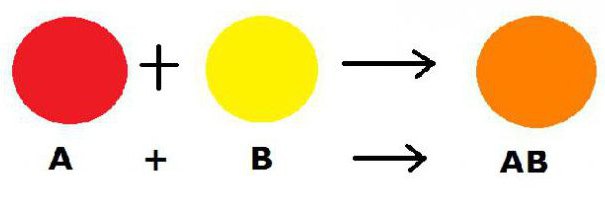
Treba napomenuti da je ova formula također karakteristična za proces dodavanja i veze.
Primjeri reakcije u obzir su interakcija natrijevog oksida i ugljičnog dioksida (NaO2 + CO2↑ (t 450-550 ° C) → Na2CO3), kao i oksid sumpora s kisikom (2SO2 + O2↑ → 2SO3).
Također, nekoliko spojeva spojeva mogu međusobno reagirati: AB + VH → ABHG. Na primjer, svi isti natrijev oksid i vodikov oksid: NaO2 + H20 → 2NaOH.
Uvjeti za reakciju u anorganskim spojevima
Kao što je prikazano u prethodnoj jednadžbi, tvari različitih stupnjeva složenosti mogu ući u interakciju koja se razmatra.

U ovom slučaju, za jednostavne reagense anorganskog porijekla moguće su reakcije oksidacije-redukcije spoja (A + B → AB).
Kao primjer, možemo uzeti u obzir proces dobivanja željeznog klorida. Za to se provodi reakcija spoja između klora i feruma (željezo): 3C12↑ + 2Fe → 2FeCl3.
U slučaju interakcije složenih anorganskih tvari (AB + VG → ABHG), mogu se pojaviti procesi u njima, koji utječu i ne utječu na njihovu valenciju.
Kao ilustraciju ovog, treba uzeti u obzir primjer stvaranja kalcijevog hidrogenkarbonata iz ugljičnog dioksida, hidrogena (voda) oksida i bijelog prehrambenog bojanja E170 (kalcijev karbonat): CO2↑ + H2O + CaCO3 → Ca (CO3)2. U tom slučaju dolazi do klasične reakcije spoja. Kada se provodi, valencija reagensa se ne mijenja.
Nešto savršenije (od prve) kemijske jednadžbe 2FeCl2 + Cl2↑ → 2FeCl3 je primjer postupka redukcije oksidacije u interakciji jednostavnih i složenih anorganskih reagensa: plin (klor) i sol (željezni klorid).
Vrste dodatnih reakcija u organskoj kemiji
Kao što je već naznačeno u četvrtom stavku, utvari organskog porijekla, predmetna reakcija se naziva "pripadnost". U pravilu, to uključuje složene tvari s dvostrukom (ili trostrukom) vezom.

Na primjer, reakcija između dibrom i etilena, što dovodi do stvaranja 1,2-dibromoetana: (C2H4) CH2= CH2 + Br2 → (C2H4Br2) BrCH2 - CH2Br. Usput, slični znakovi jednaki i negativni ("=" i "-"), u ovoj jednadžbi pokazuju veze između atoma kompleksne supstance. Ovo je značajka pisanja formula organskih tvari.
Ovisno o tome koji od spojeva djeluju kao reagensi, razlikuju se nekoliko varijanti procesa vezivanja:
- Hidrogenacija (dodavanje vodikovih molekula H na višestruku vezu).
- Hidrokloridiranje (vodikov halogenid je vezan).
- Halogeniranje (dodavanje Br halogena2, cl2↑ i slično).
- Polimerizacija (stvaranje iz nekoliko nisko molekularnih spojeva tvari s visokom molekularnom težinom).
Primjeri reakcije dodavanja (spoja)
Nakon uvrštavanja uzoraka procesa koji se razmatra, vrijedno je u praksi naučiti neke primjere reakcije spoja.
Kao ilustraciju hidrogenacije možemo obratiti pažnju na jednadžbu interakcije propena s vodikom, što će rezultirati propanom: (C3H6↑) CH3-CH = CH2↑ + H2↑ → (C3H8↑) CH3CH2CH3↑.
Spojevi organske kemije (reakcija adicije) se može odvijati između klorovodične kiseline (anorganske tvari) i etilena da nastane kloroetana (C2H4↑) CH2= CH2↑ + HCl → CH3- CH2-Cl (C2H5Cl). Prikazana jednadžba je primjer hidrohalogeniranja.

S obzirom na halogeniranje, može se ilustrirati reakcijom između dikloro i etilena, što dovodi do stvaranja 1,2-dikloretana: (C2H4↑) CH2= CH2 + Cl2↑ → (C2H4Cl2) ClCH2-CH2Cl.
Mnogo se korisnih tvarizahvaljujući organskoj kemiji. Reakcija spoja (spoj) molekula etilena s radikalnim inicijatora pod utjecajem UV svjetla - dokaza: n CH2 = CH2 (R i UV svjetlo) → (-CH2CH2-) n. Tvar stvorena na ovaj način dobro je poznata svakoj osobi pod imenom polietilena.

Iz ovog materijala su napravljene različite vrstepakete, torbe, posuđe, cijevi, izolacijske tvari i još mnogo toga. Značajka ove tvari je mogućnost recikliranja. Njegova popularnost polietilena zbog činjenice da se ne razgrađuje, zbog čega ekolozi ga negativno gledaju. Međutim, u posljednjih nekoliko godina pronađena je metoda za sigurno odlaganje polietilenskih proizvoda. Zbog toga se materijal tretira dušičnom kiselinom (HNO3). Nakon toga, određene vrste bakterija mogu raspasti tu tvar u bezopasne dijelove.
Reakcija spoja (dodavanje) igra važnu uloguulogu u prirodi i ljudskom životu. Osim toga, znanstvenici u laboratorijima često koriste sintetizaciju novih tvari za različite važne studije.




