Elektrofilno dodavanje u organskoj kemiji
Reakcije vezivanja karakterizirane su stvaranjemjedan kemijski spoj iz dva ili više polaznih materijala. Razmotriti mehanizam elektrofilnog dodavanja pogodan je za primjer alkena - nezasićenih acikličkih ugljikovodika s jednom dvostrukom vezom. Osim ovih, ostali ugljikovodici s višestrukim vezama, uključujući cikličke, unose takve transformacije.
Faze interakcije inicijalnih molekula
Elektrofilno spajanje odvija se u nekolikofaze. Elektrofilom koji pozitivni naboj djeluje kao primaoca elektrona, i dvostruke veze molekule alkena - kao elektron-donor. Oba spoja najprije tvore nestabilni p-kompleks. Potom počinje transformacija π-kompleksa u ϭ-kompleks. Formiranje karbokacije u ovoj fazi i njegova stabilnost određuju brzinu interakcije kao cjeline. Nakon toga, karbokacija brzo reagira s djelomično negativno nabijenim nukleofilom, a formira se konačni produkt transformacije.

Učinak supstituenata na brzinu reakcije
Delokalizacija naboja (ϭ +) u karbokacijiiz strukture izvornog molekula. Pozitivan induktivni učinak koji pokazuje alkil grupa vodi do nižeg punjenja susjednog ugljikovog atoma. Kao rezultat, u molekuli sa supstituentom koji daje elektron, povećava se relativna stabilnost kationa, elektronička gustoća π-veze i reaktivnost molekule kao cjeline. Učinak akceptora elektrona na reaktivnost bit će suprotan.
Mehanizam dodavanja halogena
Detaljnije ćemo analizirati mehanizam reakcije elektrofilnog dodatka primjerom interakcije alkena i halogena.
- Molekula halogena pristaje na dvostruku vezuizmeđu atoma ugljika i polariziran. Zbog djelomično pozitivnog naboja na jednom kraju molekule, halogen povlači π-bond electrons. Tako nastaje nestabilni π-kompleks.
- U sljedećem koraku, elektrofilna čestica se kombinira s dva atoma ugljika da se formira ciklus. Pojavljuje se ciklički "onium" ion.
- Preostala napunjena halogena čestica(pozitivno nabijeni nukleofil) djeluje u interakciji s ionom onium i povezan je na suprotnoj strani prethodne halogene čestice. Pojavljuje se konačni proizvod, trans-1,2-dihalogenalkan. Slično tome, dodavanje halogena na cikloalken.
Mehanizam dodavanja halogenovodičnih kiselina

Elektrofilne reakcije adicijeVodikov halogenidi i sumporna kiselina nastaju drugačije. U kiselom mediju, reagens se disocira u kation i anion. Pozitivan naboj iona (elektrofil) napada π-vezu, kombinira se s jednim od ugljikovih atoma. Karbocacioni oblici u kojima je susjedni ugljikov atom nabijen pozitivno. Nadalje, karbokacija reagira s anionom da nastane konačni proizvod reakcije.
Smjer reakcije između asimetričnih reagensa i Markovnikova pravila

Elektrofilna veza između dvaasimetrične molekule nastavljaju regioselektivno. To znači da se formira samo jedan od dva moguća izomera. Regioselektivnost opisuje Markovnikov pravilo, prema kojem se vodik vezan na ugljikov atom povezan s velikim brojem drugih atoma vodika (više hidrogeniranog).
Da bismo razumjeli bit ovog pravila, moramo se sjetitida brzina reakcije ovisi o stabilnosti intermedijarne karbokacije. Utjecaj elektrona-donora i akceptorskog supstituenta bio je gore raspravljen. Dakle, elektrofilno dodavanje bromovodične kiseline do propena rezultirat će stvaranjem 2-brompropana. Intermedijarni kation s pozitivnim nabojem na središnjem ugljikovom atomu je stabilniji od karbokacije s pozitivnim nabojem na ekstremnom atomu. Kao rezultat, atom broma reagira s drugim ugljikovim atomom.
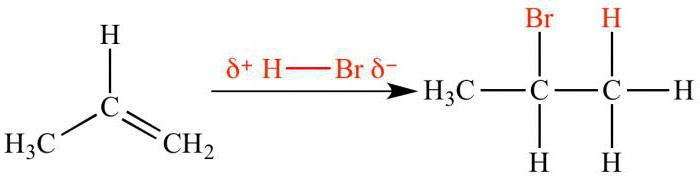
Učinak supstituenta koji privlači elektrone na tijek interakcije
Ako izvorna molekula sadržiprivlači elektron supstituentom negativno induktivni i / ili mezomerni učinak, elektrofilna dodavanja protiv navedenih pravila. Primjeri takvih supstituenata su CF3, COOH, CN. U ovom slučaju, velika udaljenost pozitivnog naboja od skupine koja privlači elektrone čini primarnu karbokaciju stabilnijom. Kao rezultat, vodik se kombinira s manje hidrogeniranim atomom ugljika.
Univerzalni verzija pravila će izgledati ovako: interakcija jednog asimetričnog alkena i jedan asimetrični reagens reakcija ide putem formiranja najstabilniji karbokationskog.