Strukturna i molekulska formula: acetilen
Značajke strukture acetilena utječu na njegova svojstva, proizvodnju i primjenu. Konvencionalna oznaka tvari - C2H2 Je li njegova najjednostavnija i bruta formula. Acetilen se sastoji od dva atoma ugljika, između kojih postoji trostruka veza. Njegova prisutnost odražava različite tipove formula i modela molekule etilena, omogućujući razumijevanje problema utjecaja strukture na svojstva materije.
Alkini. Opća formula. acetilen
Alkil ugljikovodici ili acetilen suaciklički, nezasićeni. Lanac atoma ugljika nije zatvoren, u njemu su jednostavne i višestruke veze. Sastav alkina odražava sažetak formule CnH2n - 2, U molekulama tvari ove klase postojijednu ili više trostrukih veza. Acetilenski spojevi se odnose na nezasićene spojeve. To znači da se zbog vodika ostvaruje samo jedna valencija ugljika. Preostale tri veze se koriste kada su u interakciji s drugim ugljikovim atomima.
Prvi - i najpoznatiji predstavnikalkin-acetilen ili etin. Trivijalan naziv tvari dolazi iz latinske riječi "acetum" - "octa" i grčki - "hyle" - "stablo". Utemeljitelj homologne serije otkrio je 1836. godine u kemijskim pokusima, kasnije je sintetizirana tvari ugljena i vodika E. Davy i M. Bertlo (1862). Pri normalnoj temperaturi i normalnom atmosferskom tlaku acetilen je u plinovitom stanju. To je bezbojni plin, bez mirisa, slabo topljiv u vodi. Etin je lakše topljiv u etanolu i acetonu.
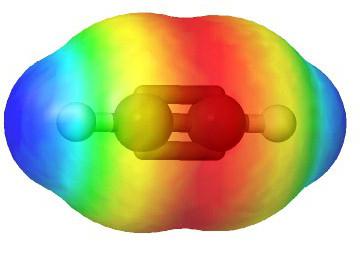
Molekularna formula acetilena
Etin - najjednostavniji član homologne serije, njegov sastav i struktura odražavaju sljedeće formule:
- C2H2 - molekularno snimanje sastava etana, što dajepojam da je tvar formirana s dva ugljikova atoma i istim brojem vodikovih atoma. Prema ovoj formuli, molekularne i molarne mase spoja mogu se izračunati. G. (Od2H2) = 26 a. npr., M (C2H2) = 26,04 g / mol.
- Н: С ::: є - formula s elektronskim točkama acetilena. Slične slike, nazvane "Lewis strukture", odražavaju elektroničku strukturu molekule. Prilikom pisanja potrebno je pridržavati se pravila: atom vodika ima tendenciju da ima konfiguraciju valne ljuske helija u formiranju kemijske veze, a ostali elementi - oktet vanjskih elektrona. Svaki debelo crijevo znači zajedničko za dva atoma ili neusklađeni par elektrona vanjske razine energije.
- H-C = C-H je strukturna formula acetilena, koja odražava red i mnoštvo veza između atoma. Jedan crtica zamjenjuje jedan par elektrona.

Modeli molekule acetilena
Formule koje prikazuju distribuciju elektrona,služio je kao temelj za stvaranje atomsko-orbitalnih modela, prostornih formula molekula (stereokemijski). Već krajem 18. stoljeća, sferni štapići su postali široko rasprostranjeni - na primjer, kuglice različite boje i veličine, označavajući ugljik i vodik, koji čine acetilen. Strukturna formula molekule je predstavljena u obliku štapova, koji simboliziraju kemijske veze i njihov broj u svakom atomu.

Sferni model acetilena se reproduciravalentni kutovi jednaki 180 °, no internuclear udaljenosti u molekuli odražavaju se približno. Šupljine između kuglica ne stvaraju sliku punjenja prostora atoma s gustoćom elektrona. Nedostatak je uklonjen u modelima driding, koji označavaju jezgre atoma ne s kuglicama, već s točkama pričvršćivanja šipki jedni prema drugima. Suvremeni volumetrijski modeli daju živopisniju ideju atomskih i molekularnih orbitala.
Hibridne atomske orbite acetilena
U ugljenu u uzbudljivom stanju sadrže tri P-orbita i jedan s neuparenih elektrona. U formiranju metana (CH4) sudjeluju u stvaranju jednakihveze s atomima vodika. Poznati američki istraživač L. Pauling razvio je teoriju hibridnog stanja atomskog orbita (AO). Objašnjenje ponašanja ugljika u kemijskim reakcijama je poravnanje AO u formi i energiji, stvaranje novih oblaka. Hibridni orbitali daju jače veze, formula postaje stabilnija.
Atomi ugljika u molekuli acetilena, za razliku odmetana, prolaze kroz sp-hibridizaciju. S i p elektroni se miješaju u obliku i energiji. Pojavljuju se dva sp-orbita, ležeći pod kutom od 180 °, usmjerenih na suprotne strane jezgre.

Trostruka veza
U acetilenskim hibridnim elektronskim oblacima ugljikasudjeluju u stvaranju σ-veza s istim susjednim atomima i vodikom u CH parovima. Postoje dva ne-hibridna P-orbita okomita jedni prema drugima. U etilenskoj molekuli sudjeluju u stvaranju dviju π-veza. Zajedno s σ postoji trostruka veza koja odražava strukturnu formulu. Acetilen se razlikuje od etana i etilena udaljenost između atoma. Trostruka veza je kraća od dvostrukog, ali ima veću rezervu energije, čvršće je. Maksimalna gustoća σ- i π-veza nalazi se u okomitim područjima, što dovodi do formiranja cilindričnog oblika elektrona.
Značajke kemijske veze u acetilenu
Etilenska molekula ima linearni oblik, koji je uspješanodražava kemijsku formulu acetilen-H-C = C-H. Atomi ugljika i vodika su uzduž ravne linije, između njih postoje 3 σ- i 2 π-veze. Slobodno kretanje, rotacija duž osi C-C je nemoguće, to je spriječeno prisutnošću višestrukih veza. Ostale značajke trostrukog veza:
- broj parova elektrona koji povezuju dva ugljikova atoma je 3;
- duljina - 0,120 nm;
- Energija rupture je 836 kJ / mol.
Za usporedbu: u molekulama etana i etilen jednu dužinu i dvostruke veze - 1.54 kemijske i 1.34 nm, odnosno energije razmak C-C 348 kJ / mol, C = C - 614 kJ / mol.

Homologi acetilena
Acetilen je najjednostavniji predstavnik alkina, čije molekule također imaju trostruku vezu. Propyn CH3Sonos - homolog acetilena. Formula trećeg predstavnika alkina - butin-l-CH3CH2S≡SN. Acetilen je trivijalan naziv etana. Sustavna nomenklatura alkina podliježe IUPAC pravilima:
- u linearnim molekulama, dodana je naziv glavnog lanca, koji nastaje iz grčkog brojeva, na koji se dodaju sufiks -in i broj atoma trostruku vezu, na primjer, etin, propin, butin-1;
- numeriranje glavnog lanca atoma počinje na kraju molekule koja je najbliža trostrukoj vezi;
- za razgranate ugljikovodike prvo slijedi naziv bočne grane, nakon čega slijedi naziv glavnog lanca atoma s sufiksom -in.
- krajnji dio imena - broj koji ukazuje na položaj trostruke veze u molekuli, na primjer, butin-2.

Izomerizam alkina. Ovisnost svojstava na strukturi
Ethine i propyne nemaju izomere triplepojavljuju se, počevši od Butina. Izomeri ugljikovog kostura nalaze se u pentenu i slijedećim homologima. Prostorni izomerizam acetilenskih ugljikovodika se ne očituje u odnosu na trostruku vezu.
Prvih 4 homologa etanola su plinovi koji su slabo topljivi u vodi. Acetilen ugljikovodici C5 - C15 - tekućina. Krutine su hometi etana, počevši od ugljikovodika C17, Kemička priroda alkina prolaziznačajan utjecaj trostruke veze. Ugljikovodici ovog tipa aktivniji su od etilena, a vezane su različite čestice. Ova se nekretnina temelji na širokoj upotrebi etana u industriji i inženjeringu. Kada se spali acetilen, oslobađa se velika količina topline koja pronalazi primjenu u rezanju plina i zavarivanju metala.